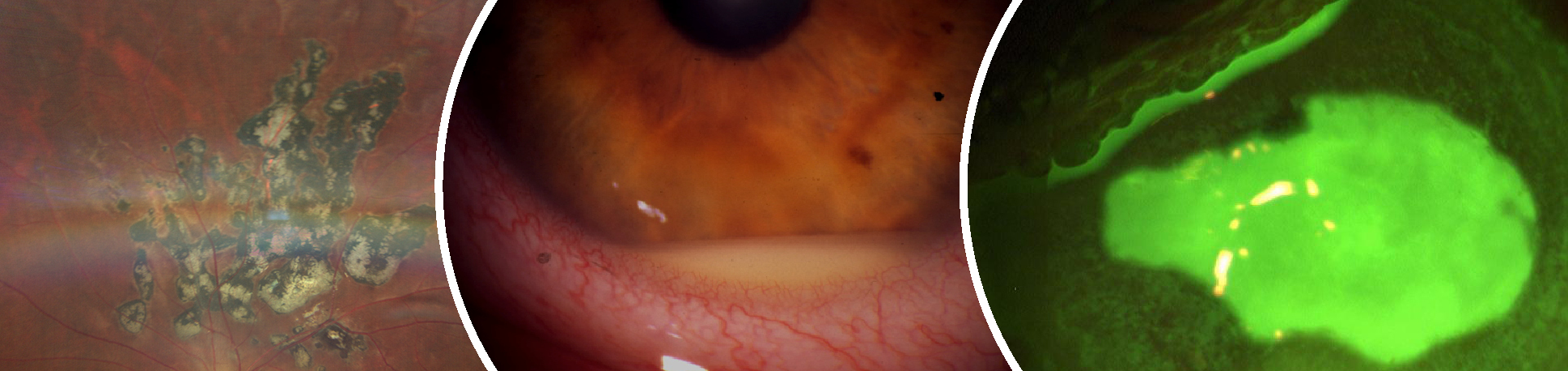
Malattie Infettive della Superficie Oculare
Cheratite da Acanthamoeba, a cura di Paolo Rama e Stanislav Matuska
INTRODUZIONE
Amebe cosiddette “a vita libera” quali Acanthamoeba spp., Naegleria fowleri, Balamuthia mandrillaris sono protozoi diffusi ubiquitariamente nell’ambiente. Possono causare infezioni oculari, soprattutto cheratiti, in soggetti normoergici, in particolare se utilizzatori di lenti a contatto (LAC) o in seguito a traumi con materiale organico. Vista l’enorme diffusione di queste amebe nell’ambiente, acque potabili comprese, una corretta igiene nella conservazione e nella manipolazione delle LAC potrebbe ridurre la frequenza di questa patologia che è invece in continuo aumento. La diagnosi precoce è fondamentale ed il trattamento, con i farmaci attualmente disponibili, è oggi efficace e in grado di risolvere definitivamente l’infezione, se iniziato presto e correttamente.
CLINICA
Non è possibile stabilire con sicurezza l’intervallo temporale tra l’acquisizione dell’infezione ed il momento in cui si manifestano i primi segni e sintomi.Comunque la fase di esordio può durare diverse settimane, con sintomatologia lieve e sfumata. I sintomi sono aspecifici e possono andare da una semplice sensazione di corpo estraneo a lievi disturbi (modesta irritazione oculare). Può essere presente iperemia congiuntivale, ma il paziente non avverte ancora dolore. Al contrario, in questa fase è stata descritta una riduzione della sensibilità corneale (Moore et al., 1986; Auran et al., 1987) che può erroneamente indirizzare verso la diagnosi di cheratite erpetica.
La cornea può presentare microcisti subepiteliali che, rompendosi, daranno origine a lesioni epiteliali molto simili a quelle erpetiche (pseudodendrite) (Fig. 1). In seguito compare la limbite, iperemia congiuntivale pericheratica, cosiddetta perché caratteristicamente localizzata in prossimità del “limbus” (Fig.2). La diagnosi differenziale in questa fase deve comprendere le cheratiti sterili e quelle infettive. Le cheratiti non infettive possono essere secondarie ad un abuso della LAC o a reazioni tossiche o allergiche al liquido di conservazione delle LAC o a medicamenti. Le cheratiti infettive invece devono comprendere le forme erpetiche, quelle batteriche (in particolare da batteri atipici come i micobatteri o Nocardia spp.) e le micotiche.
Lo stadio intermedio è caratterizzato dalla comparsa della sintomatologia: intensa fotofobia, lacrimazione e dolore, solitamente sproporzionato all’entità del quadro clinico. A livello corneale si evidenziano segni di coinvolgimento dello stroma, inizialmente caratterizzato da un infiltrato con epitelio integro, seguito poi da ulcerazione (Fig.3). Spesso è presente un infiltrato “ad anello” attorno al focolaio infettivo, segno della risposta immunitaria dell’ospite e in questa fase compaiono gli infiltrati perineurali con distribuzione radiale.
Nello stadio più avanzato si osserva un ulteriore peggioramento della sintomatologia, che a volte è accompagnata da un dolore così intenso da richiedere l’uso di antidolorifici maggiori (morfina). Anche il quadro clinico si aggrava ulteriormente e compare una necrosi colliquativa, che può portare alla perforazione (Fig. 4). In questa fase possono comparire anche segni di compromissione del segmento anteriore con midriasi areagente ed atrofia iridea, cataratta, ipertono e/o coinvolgimento sclerale.
Una volta risolta l’infezione, a seconda della gravità del quadro clinico e soprattutto del tempo intercorso dalla diagnosi all’inizio del trattamento, la riparazione può avvenire con ripristino di tessuto corneale trasparente oppure con la formazione di un leucoma. Solitamente la cornea si vascolarizza nella prima fase della guarigione e una volta terminato il processo riparativo i vasi spontaneamente si schiudono lasciando, il più delle volte, un leucoma non vascolarizzato. A distanza di settimane dalla risoluzione del processo infettivo può verificarsi una recrudescenza della sintomatologia causata dalla comparsa di infiltrati subepiteliali e stromali, da depositi endoteliali e da uveite anteriore, che non rappresentano una riacutizzazione dell’infezione, ma una risposta immunitaria ad antigeni parassitari sequestrati.
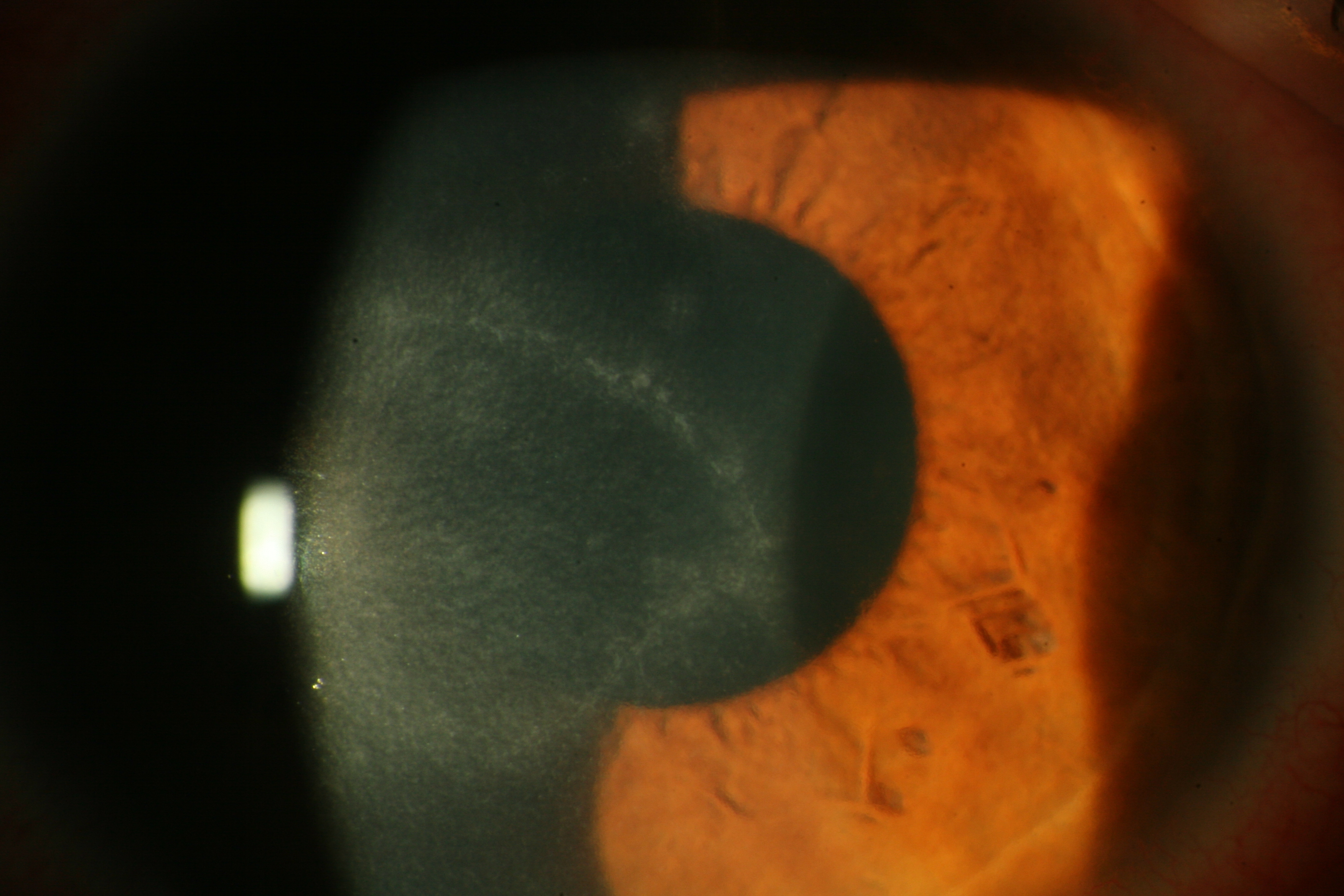
Fig.1
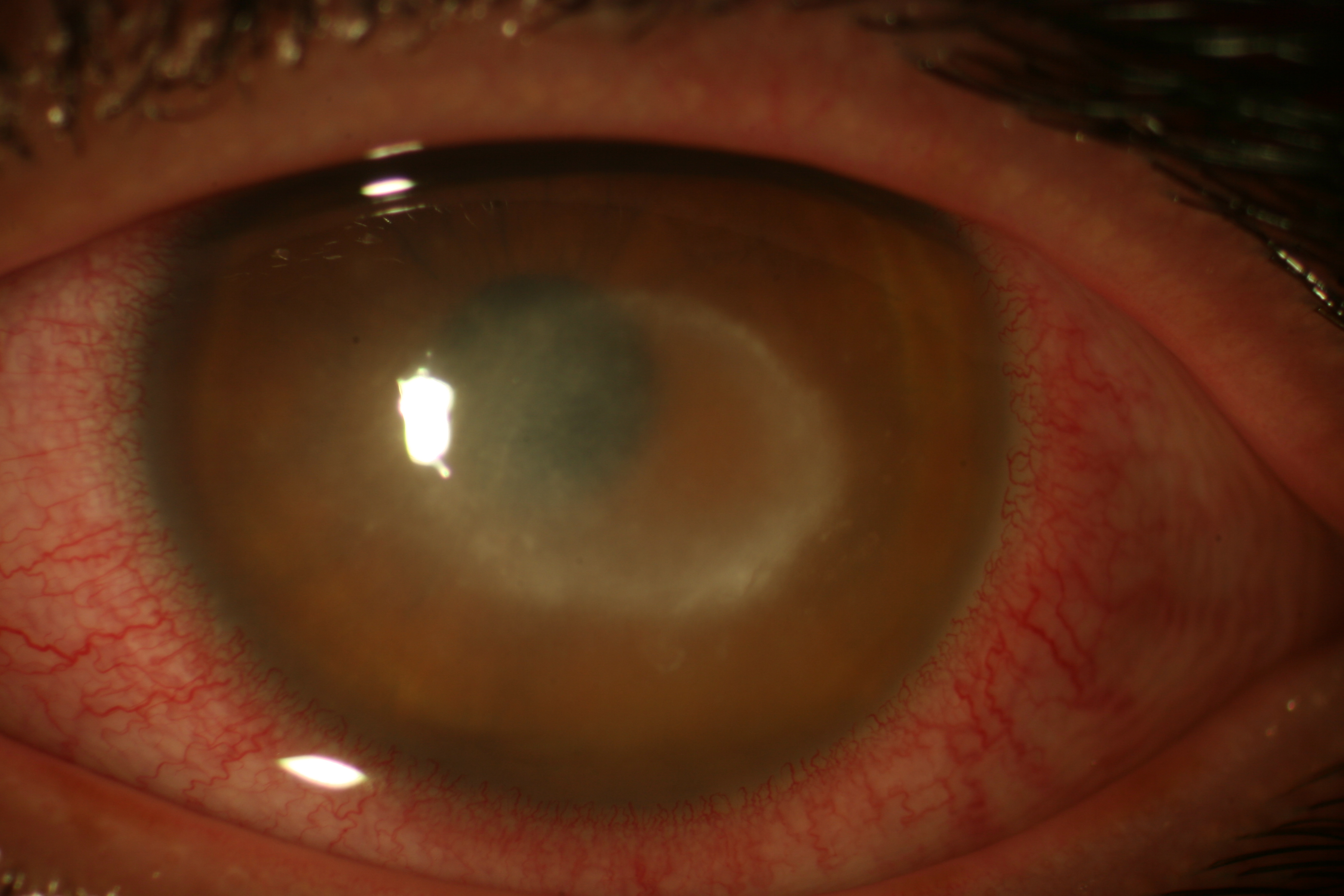
Fig.2
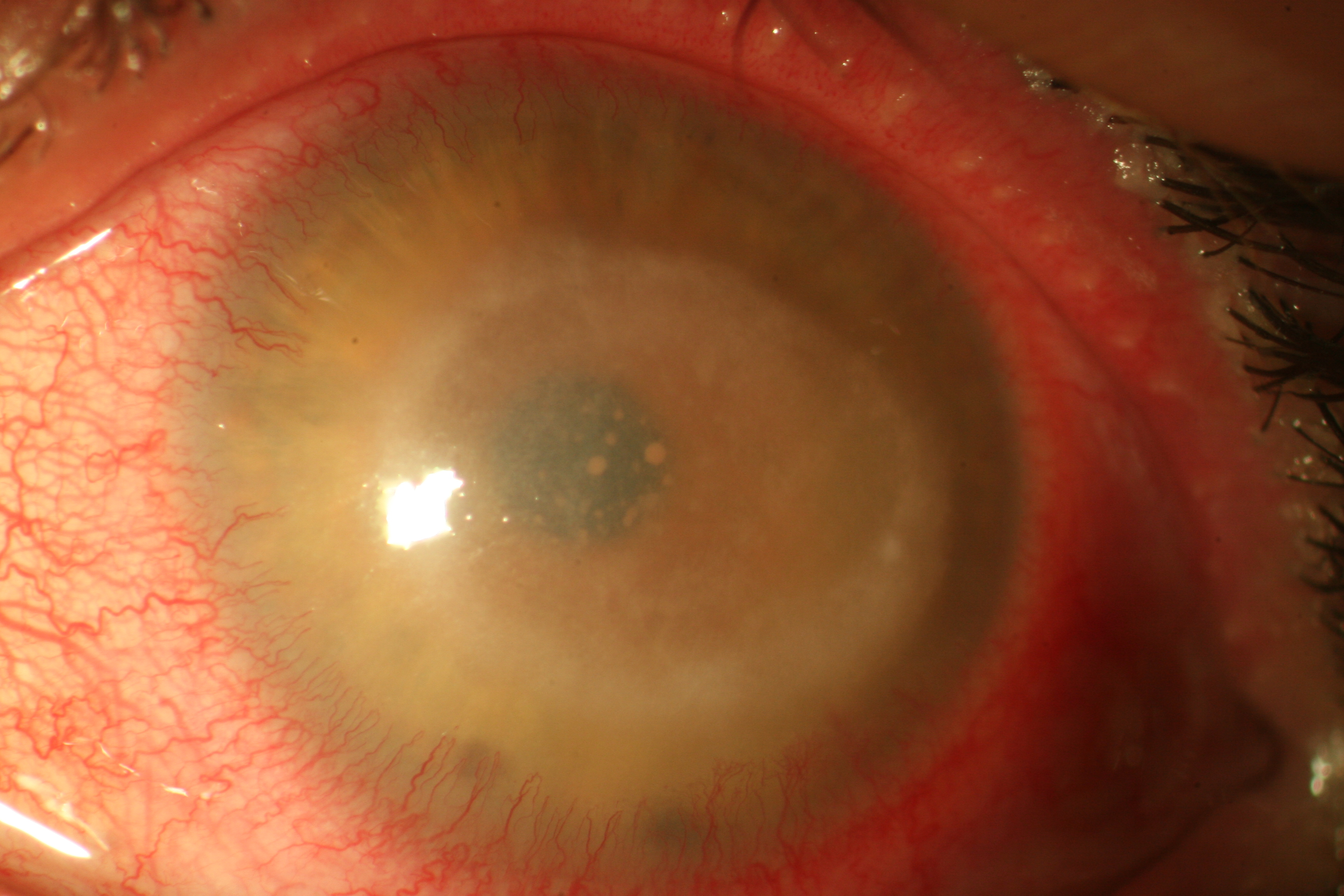
Fig.3
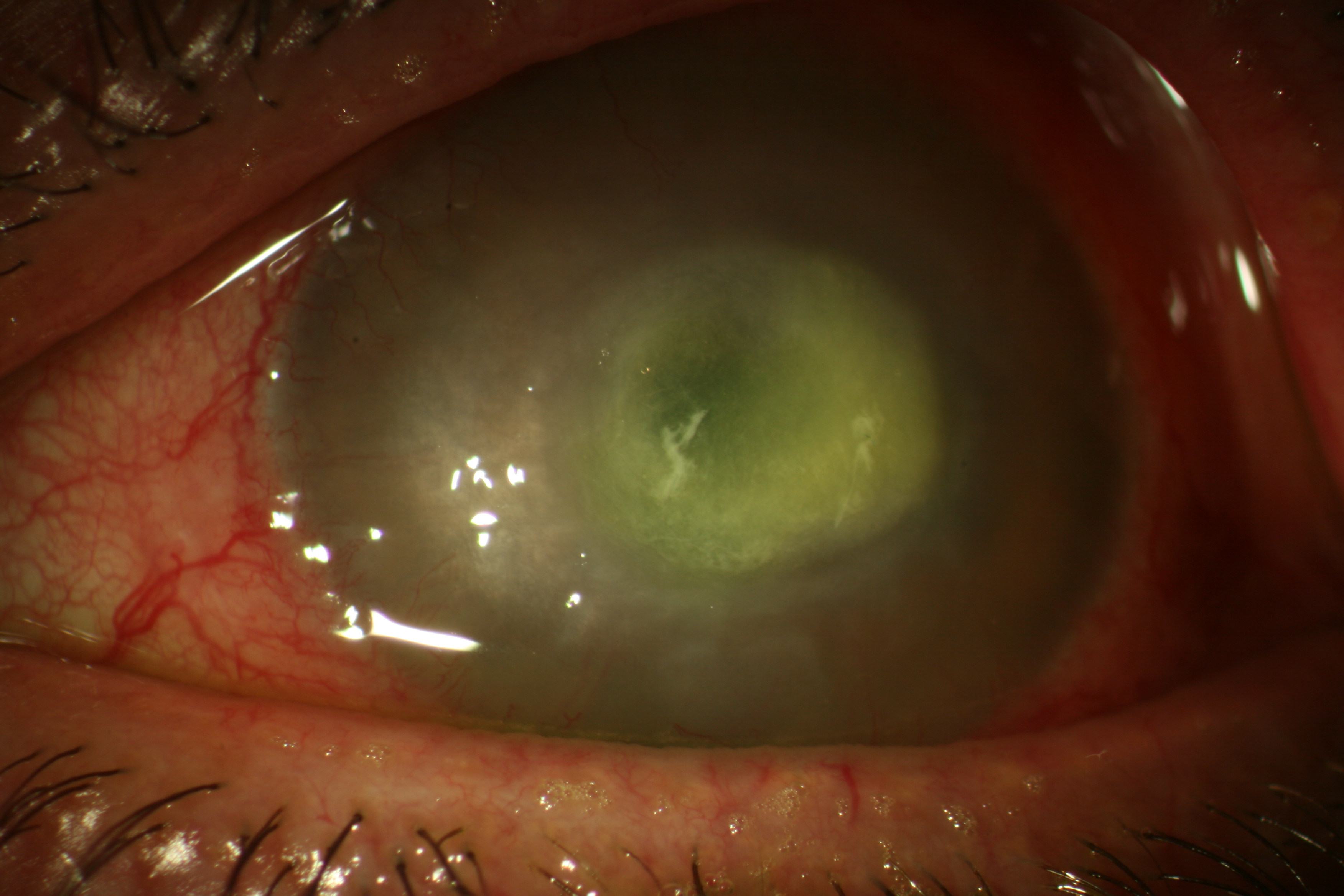
Fig.4
DIAGNOSI
La diagnosi di cheratite da Acanthamoeba si basa sulla identificazione microscopica diretta e/o colturale delle cisti e dei trofozoiti previo prelievo di epitelio o di tessuto in disfacimento sui bordi dell’ulcera mediante spatola. In alcuni casi il focolaio infettivo può essere così profondo da richiedere un prelievo di stroma mediante biopsia. Quando possibile è sempre indicato eseguire la ricerca del parassita anche nel liquido di conservazione delle LAC e sulle LAC stesse opportunamente frammentate ed entrambi posti in coltura. Gli esami microbiologici dovrebbero comunque sempre comprendere la ricerca di batteri, miceti e virus erpetico perché non è infrequente che la cheratite amebica si associ ad infezioni concomitanti che andranno anch’esse adeguatamente trattate.
Nella fase iniziale dell’infezione, quando la membrana di Bowman non è ancora stata superata, il prelievo ha anche un valore terapeutico, in quanto viene rimosso il parassita. Per questo motivo, conviene sempre asportare un’ampia zona di epitelio allo scopo di eliminare tutte le cellule eventualmente infettate.
a) Microscopia diretta:
Le apposizioni o gli “scraping” su vetrino vanno colorati con colorazioni di Gram, Giemsa, PAS, mentre le metodiche tintoriali effettuate su fettine istologiche sparaffinate sono preferenzialmente Giemsa istologico e PAS. Con il microscopio a fluorescenza è possibile evidenziare le cisti ed i trofozoiti dopo colorazione con “calcofluor white”. Si tratta di un fluorocromo che si lega alla cellulosa ed alla chitina presenti nella doppia parete delle cisti, conferendo una chemofluorescenza giallo-verde. I trofozoiti appaiono invece colorati in arancione. Un altro colorante che può essere utilizzato è il lattofenolo cotton blu: in questo caso le cisti appaiono come strutture a doppia parete che si colorano di blu più scuro rispetto al tessuto corneale circostante. Un’ulteriore metodica tintoriale si affida all’utilizzo di lectine fluoresceina-coniugate, come la concanavalina A, che hanno il vantaggio di colorare sia le cisti che i trofozoiti. L’analisi in immunofluorecenza diretta permette di identificare facilmente cisti e trofozoiti, ma è attuabile solo in alcuni laboratori di riferimento.
b) Esame colturale:
Il terreno di coltura sia di isolamento che di mantenimento normalmente utilizzato è un agar non nutriente (NN-agar) al 3%, frazionato in piastre Petri e, dopo solidificazione, batterizzato sterilmente in superficie con sospensione lattescente di una specie batterica Gram – (Escherichia coli, Enterobacter aerogenes ecc.) che funge da supporto nutritivo per le amebe. Dopo alcuni giorni di incubazione a 32°-35°C possono evidenziarsi le forme vegetative in attiva moltiplicazione che causano aree di “spoliazione” del substrato batterico per meccanismi di fagocitosi. E’ opportuno che le piastre vengano tenute in osservazione per almeno 4 settimane poiché talora sono necessari tempi decisamente più lunghi per l’isolamento del ceppo amebico. L’isolamento di Acanthamoeba può anche essere tentato in terreni monofasici liquidi, senza flora batterica come supporto nutritivo (coltura axenica). La coltura axenica (terreno di Fulton, GCVS ecc.) viene di norma effettuata in seconda battuta partendo da una coltura su NN-agar previa eliminazione della flora batterica di accompagnamento. Le colture axeniche permettono di ottenere una popolazione amebica omogenea “pura” che può essere utilizzata per test di farmaco sensibilità in vitro, infezioni sperimentali, test di tipizzazione biochimica e molecolare ecc.
c) Microscopia confocale:
Si tratta di una metodica non invasiva che consente di mettere in evidenza le cisti e i trofozoiti nel tessuto corneale che appaiono come strutture iperiflettenti. L’esame richiede però una buona collaborazione del paziente e, spesso, l’intensa fotofobia ed il dolore ne possono rendere problematica l’esecuzione.
d) Tecniche di Polymerase chain reaction (PCR):
Molto sensibili e specifiche, consentono di dimostrare la presenza di Acanthamoeba anche in quantità minimali di tessuto corneale. Sono ancora in fase sperimentale ed eseguibili in laboratori di ricerca o di riferimento.
TRATTAMENTO
Quando l’infezione è ancora in fase iniziale ed il parassita infiltra solo l’epitelio corneale, il processo patologico può essere facilmente risolto con la semplice rimozione meccanica della zona interessata con spatola, con antisettici o con antibiotici aminoglicosidici fortificati. Quando invece il parassita ha già raggiunto lo stroma corneale l’approccio terapeutico diventa più arduo, anche in relazione alla capacità del protozoo di incistarsi. Le cisti sono infatti molto più resistenti al trattamento farmacologico rispetto ai trofozoiti ed impongono cicli di terapia più prolungati e dall’esito a volte incerto.
Diversi farmaci si sono dimostrati efficaci nel distruggere le cisti ed i trofozoiti di Acanthamoeba spp. in vitro; peraltro, poiché tuttora non si dispone di un valido modello animale, non è stato possibile confermare questi dati in vivo. Clinicamente si è poi osservato che i risultati migliori si ottengono con l’associazione di almeno due principi attivi, ma anche la monoterapia si è rivelata efficace. Infine, sempre su casi umani in corso di trattamento, è stato dimostrato che si possono instaurare resistenze ad un principio attivo inizialmente efficace.
I principi attivi sulle cisti e sui trofozoiti di Acanthamoeba spp. individuati sino ad oggi sono:
- derivati della diamidina: propamidina isetionato 0.1% (Brolene® collirio), dibrompropamidina 0.15% (Brolene® pomata), esamidina 0.1% (Desomedine® collirio), pentamidina isetionato
- agenti antisettici: poliesametilenebiguanide (PHMB) e clorexidina, entrambi in soluzione allo 0.02%
- derivati azolici: miconazolo 1%, clotrimazolo 1%, chetoconazolo, itraconazolo
- aminoglicosidi: neomicina, paromomicina
- Povidone iodato 0.5% (Betadine®)
Recentemente è stata segnalata in letteratura l’efficacia in vitro di voriconazolo (Schuster et al., 2006), confermata successivamente anche in vivo, sia per via topica che intrastromale, in alcuni casi di pazienti con cheratite da Acanthamoeba resistente all’associazione clorexidina-esamidina (Bang et al., 2010).
Facendo riferimento alla letteratura, il trattamento si basa sull’associazione di una biguanide (PHMB o clorexidina) con una diamidina (Desomedine® o Brolene®) (Elder et al., 1994; Hay et al., 1994, Elder e Dart, 1995; D’Aversa et al., 1995; Seal et al., 1995; Tirado-Angel et al., 1996; Seal et al., 1996; Duguid et al., 1997; Niederkorn, 2002; Narasimhan et al., 2002).
E’ riportato tuttavia che anche la monoterapia con una biguanide può essere efficace (Lim et al., 2008).
Clinicamente si è osservato anche che, in corso di trattamento, si possono instaurare resistenze ad un principio attivo inizialmente efficace (Wysenbeek et al., 2000; Narasimhan et al., 2002).
Protocolli di trattamento.
La terapia deve essere instaurata il più rapidamente possibile per cui il trattamento può essere iniziato subito dopo avere eseguite il prelievo corneale; la risposta dell’esame colturale può richiedere anche diverse settimane. Il protocollo più utilizzato prevede l’associazione di PHMB 0.02% o clorexidina 0.02% con Brolene® o Desomedine®. Si inizia con somministrazioni ogni ora durante il giorno, evitando la notte, per circa 1-2 settimane, riducendo in seguito in base alla risposta. E’ importante tuttavia ricordare, informando di questo il paziente, che i farmaci sono tossici e possono comportare un iniziale peggioramento del quadro infiammatorio e della sintomatologia, che non va interpretato come un aggravamento dell’infezione. La terapia va mantenuta 3-4 volte al giorno per almeno un mese dalla guarigione clinica, per il rischio che eventuali cisti sopravvissute possano riaccendere il processo. Gli aminoglicosidici, come la neomicina, non sono sempre efficaci e sono gravati inoltre da un’elevata tossicità per il tessuto corneale. La soluzione di Betadine® 0.5% può essere utilizzata nelle forme superficiali, soprattutto per “toccatura” dopo il prelievo per l’esame microbiologico (Gatti et al., 1998). Può inoltre essere usata temporaneamente nelle ulcere, in attesa di procurarsi i farmaci considerati di prima scelta, mentre non ha alcuna efficacia nella cheratite stromale perché non è in grado di penetrare nello stroma quando l’epitelio è integro. Il cicloplegico può ridurre la congestione ciliare e migliorare il dolore. Per il dolore è consigliato utilizzare farmaci per via generale, anche con l’aiuto di specialisti di terapia antalgica, per la gravità che spesso caratterizza il quadro. Sono sconsigliati gli antiinfiammatori non steroidei, per il rischio di aggravare le reazioni tossiche e sono assolutamente da evitare gli anestetici topici per il grave rischio di necrosi colliquativa e perforazione. Il cortisone va evitato nella fase iniziale del trattamento mentre può essere indicato una volta migliorato il quadro infettivo per ridurre la componente infiammatoria associata. Va comunque utilizzato con estrema cautela.
Problemi in corso di trattamento.
La terapia è lunga ed impegnativa e la sua gestione richiede un’adeguata esperienza perché non è sempre facile valutare la risposta al trattamento e le complicanze possono essere molto gravi e di difficile gestione. La resistenza alla terapia può instaurarsi anche in corso di trattamento e va distinta dalla tossicità indotta dai farmaci. In caso di peggioramento in corso di trattamento si può sospendere ogni terapia ed osservare la risposta: se il quadro clinico migliora, si può concludere che si trattava di tossicità da farmaci e sostituire uno dei farmaci utilizzati con un analogo (ad es. PHMB con clorexidina o viceversa) o ridurre il numero di somministrazioni. In caso di mancato miglioramento, si deve invece concludere che si trattava di resistenza; a tal proposito si può sostituire un farmaco con un analogo (come sopra) oppure aumentarne la concentrazione. Il PHMB è tollerato anche alla concentrazione di 0.04% e 0.06% (De Freitas, 2010). Sebbene il meccanismo d’azione del PHMB sia analogo a quello della clorexidina, in un caso di acanthamebiasi resistente ad entrambi i farmaci, confermato dalla positività alla coltura dopo ripetuti prelievi, abbiamo potuto osservare che l’associazione dei due farmaci ha consentito di risolvere l’infezione. L’effetto dell’associazione delle due biguanidi potrebbe essere il medesimo di quello ottenuto con l’aumento della concentrazione sopra riportato. Riguardo alla sospensione del trattamento, si deve ricordare che, a differenza delle infezioni batteriche ed anche micotiche, la progressione dell’infezione amebica è molto lenta, per cui non vi è alcun rischio nel sospendere momentaneamente la terapia eziologica. La temporanea sospensione dei farmaci antiamebici è stata anche proposta come terapia “pulsata”, allo scopo di favorire il passaggio del parassita dalla forma cistica, più resistente, a quella vegetativa, molto più sensibile ai farmaci. Nei casi in cui non si ottiene alcun miglioramento, nonostante tutti questi accorgimenti, è consigliabile ripetere il prelievo corneale e procedere a nuovi esami di laboratorio per Acanthamoeba, batteri e miceti.
Nei casi di progressivo peggioramento nonostante la terapia, è stato proposto il ricoprimento congiuntivale. E’ stato dimostrato che l’apporto di sangue con il tessuto congiuntivale può avere un effetto positivo sia sulla necrosi colliquativa che sulla componente infettiva.
La prevenzione si basa praticamente sull’evitare il contatto della lente con acqua contaminata, dal momento che Acanthamoeba ha una diffusione ubiquitaria. Si consiglia quindi di evitare l’uso di LAC in piscina o sotto la doccia, di non lavarle sotto l’acqua del rubinetto e di sostituire frequentemente il contenitore delle lenti.
BIBLIOGRAFIA
Auran JD, Stan MB. Jakobiec FA – Acanthamoeba keratitis. A review of the literature. Cornea 6: 2-26; 1987
Bang S, Edell E, Eghrari AO, Gottsch JD – Treatment with voriconazole in 3 eyes with resistant Acanthamoeba keratitis. Am.J.Ophthalmol. 149: 66-69; 2010
Dart JKG, Saw VPJ, Kilvington S – Acanthamoeba keratitis: Diagnosis and Treatment- Update 2009. Am.J.Ophthalmol. 148: 487-499; 2009
D’Aversa G, Stern GA, Driebe WT.- Diagnosis and successful medical treatment of Acanthamoeba keratitis. Arch.Ophthalmol. 113: 1120-1123; 1995
De Freitas D – Newer antifungal agents (Relazione). World Cornea Congress, Boston, 7-9 Aprile 2010
Duguid IG, Dart JK, Morlet N, Allan BD, Matheson M, Ficker L, Tuft S – Outcome of Acanthamoeba keratitis treated with polyhexamethyl biguanide and propamidine. Ophthalmology 104: 1587-1592; 1997
Elder MJ, Kilvington S, Dart JKG – A clinicopathologic study of in vitro sensitivity testing and Acanthamoeba keratitis. Invest.Ophthalmol.Vis.Sci. 35: 1059-1064, 1994
Elder MJ, Dart JKG – Chemotherapy for Acanthamoeba keratitis. Lancet 345: 791-792; 1995
Gatti S, Cevini C, Bruno A, Penso G, Rama P, Scaglia M. In vitro effectiveness of povidone-iodine on Acanthamoeba isolates from human cornea. Antimicrob Agents Chemother 42: 2232-4; 1998.
Hay J, Kirkness CM, Seal DV, Wright P. – Drug resistance and Acanthamoeba keratitis: the quest for alternative protozoal chemotherapy. Eye 8: 555-563; 1994
Illingworth CD, Cook SD – Acanthamoeba keratitis. Surv.Ophthalmol. 42: 493-508; 1998
Lim N, Goh D, Bunce C, Xing W, Fraenkel G, Poole TRG, Ficker L - Comparison of polyhexamethylene biguanide and chlorexidine as monotherapy agents in the treatment of Acanthamoeba keratitis. Am.J.Ophthalmol. 145: 130-135; 2008
Moore MB, Mc Culley JP, Kaufmann HE, Robin JB – Radial keratoneuritis as a presenting sign in Acanthamoeba keratitis. Ophthalmology 93: 1310-1315; 1986
Narasimhan S, Madhavan HN, Lily T - Development and application of an in vitro susceptibility test for Acanthamoeba species isolated from keratitis to polyhexamethylene biguanide and chlorexidine. Cornea 21: 201-205; 2002
Niederkorn JY – The role of the innate and adaptative immune resposnses in Acanthamoeba keratitis. Arch.Immunol.Ther.Exp. (Warsz) 50: 53-59; 2002
Seal DV, Hay J, Kirkness CM - Chlorexidine or polyhexamethylene biguanide for Acanthamoeba keratitis. Lancet 345: 136; 1995
Seal DV, Hay J, Kirkness C, Morrell A, Booth A, Tullo A, Ridgway A, Armstrong M – Successful medical therapy of Acanthamoeba keratitis with topical chlorexidine and propamidine. Eye 10: 413-421; 1996
Schuster FL, Guglielmo BJ, Visvesvara GS – In-vitro activity of miltefosine and voriconazole on clinical isolates of free-living amoebas: Balamuthia mandrillaris, Acanthamoeba spp., and Naegleria fowleri. J.Eukaryot.Microbiol. 53: 1212-126; 2006
Tirado-Angel J, Gabriel MM, Wilson LA, Ahearn DG - Effects of polyhexamethylene biguanide and chlorexidine on four species of Acanthamoeba in vitro. Curr. Eye Res. 15: 225-228; 1996
Wysenbeek YS, Blank-Porat D, Harizman N, Wygnanski-Jaffe T, Keller N, Avni I - The reculture technique: individualizing the treatment of Acanthamoeba keratitis. Cornea 19: 464-467; 2000
